肝切除术是肝细胞癌(HCC)患者的主要治疗方式之一。然而,肝切除术后的肿瘤复发率很高,五年内的术后复发率约为70%,且只有23%的复发HCC患者能够生存5年以上。目前已有一些研究将HCC复发与几个临床特征相关联,包括肿瘤大小、病变数量、分化程度和血管侵袭的存在。然而,这些临床病理指标提供的对复发的潜在分子理解尚不够全面,并且也没有提供足够的干预证据来预防HCC复发。目前人们对导致HCC术后复发的空间组织结构改变仍然知之甚少。
近日,中山大学附属第五医院李丹研究员、单鸿教授和李曼研究员作为共同通讯,在Hepatology(IF = 12.9)上发表了题为“Spatial proteomic landscape of primary and relapsed hepatocellular carcinoma reveals immune escape characteristics in early relapse”的文章。该研究利用成像质谱流式技术(Imaging mass cytometry, IMC)全面解析了原发和复发HCC的空间单细胞蛋白质组图谱,并揭示了一个复发HCC中由PD-L1+CD103+ DC细胞与Treg细胞和Tex细胞共同构建的免疫抑制与逃逸微环境。这项研究为我们理解驱动HCC复发的免疫逃避机制提供了深入的解析,并为开发针对HCC复发的干预策略提供了指引。

为探究原发性和复发性HCC的肿瘤微环境之间的时空变化,作者收集了原发性(PT)和复发性(RT)HCC患者的肿瘤样本。作者通过IMC检测33个蛋白marker总共鉴定了21个细胞群体,以及多个亚型,并将单细胞亚型映射到相应的组织切片图像上(图1),阐明了原发和复发HCC中主要细胞谱系的空间分布。
作者对PT和RT患者的不同空间位置的肿瘤细胞进行了相关性分析,发现免疫细胞在频率和密度都发生了一系列改变,表明了不同表型之间的免疫重编程过程,阐明了特定细胞群体的空间聚集与临床病理表型的密切相关性。作者发现,与晚期复发RT样本相比,早期复发RT中上皮-间充质转化细胞的出现频率和密度显著升高,这为预后较差的早期复发患者的发病原因提供了可能的分子解释。
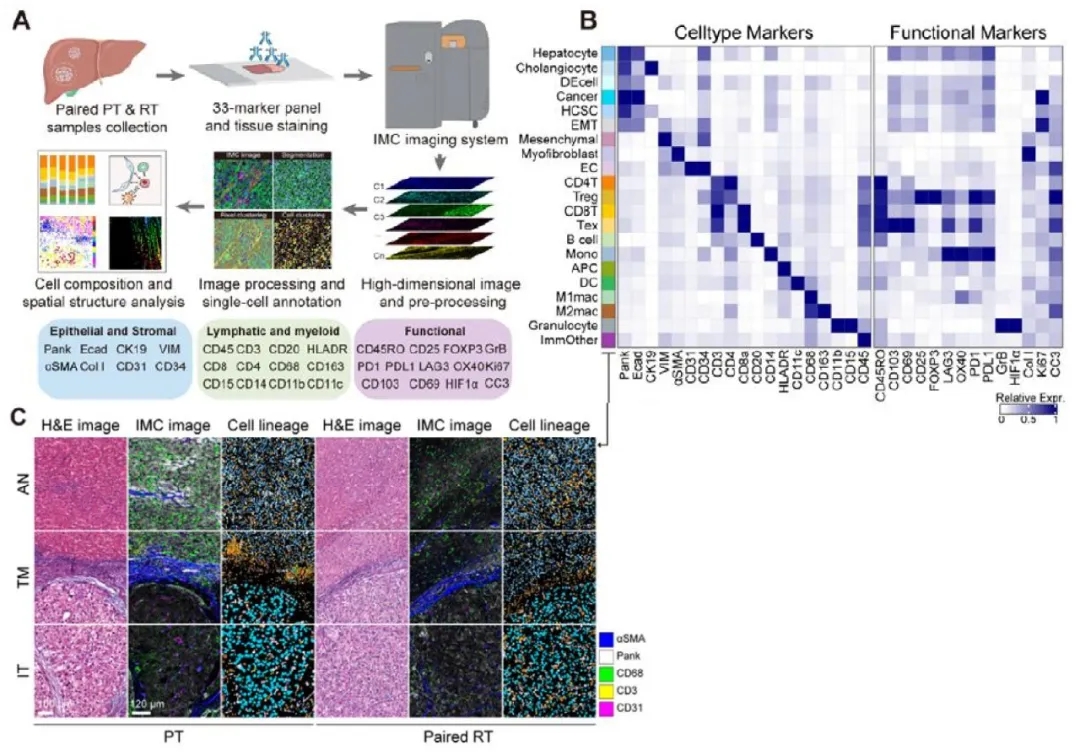
图1 通过IMC描绘原发和复发HCC患者间空间分子差异
为了解析空间组织结构中细胞互作的模式,作者量化了细胞群体的共定位数据,发现个体细胞状态与细胞周围环境的结构组成具有密切联系。作者发现,与PD-L1+的癌细胞相比,PD-L1-的癌细胞更容易受到抗肿瘤免疫的影响(图2A、B)。此外,Ki67-癌细胞倾向于与肿瘤边缘的免疫群体发生互作,而Ki67+的癌细胞似乎逃避这种互作(图2C),这表明肿瘤增殖行为通常伴随着对免疫监视和攻击的逃避。在原发性肿瘤边缘区域,CD8+T细胞与M2型巨噬细胞的互作较少;而在复发性肿瘤边缘区域,CD8+ T细胞与M2型巨噬细胞之间的互作增强,这表明复发性肿瘤中对CD8+ T细胞的免疫抑制作用增强(图2D)。
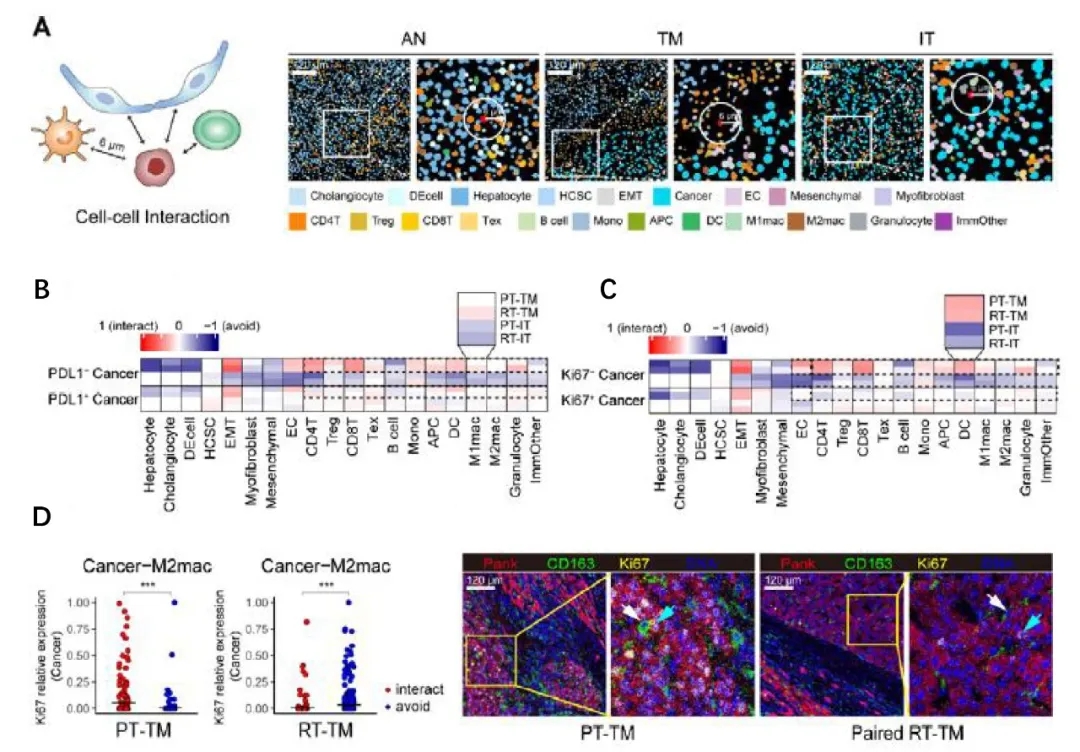
图2 原发性和复发性HCC之间不同的空间细胞特征
从空间信息特征揭示PD-L1+CD103+ DC细胞与早期HCC复发的相关性
接下来,作者利用肿瘤微环境的空间信息参数探究早期和晚期复发患者之间分子特征的区别。作者开发了一种使用空间参数预测患者两年内是否复发的预测模型,该预测模型主要依据免疫表型和各种免疫细胞亚群的空间分布特征(图3A),该模型具有很高的的预测性能(图3B)。该模型中,DC细胞相关的空间特征占较大的比重,因此作者比较了早期和晚期复发的病人样本不同的DC亚群,发现了一簇DC细胞亚群显著在早期复发样本中高度存在(图3C、D),这簇细胞高表达CD103和PD-L1,具有免疫抑制、组织驻留性的特点(图3E)。作者进一步分析发现PD-L1+CD103+ DC细胞与复发时间缩短有关(图3F)。作者又对90例HCC患者进行了CD103和PD-L1的多重免疫荧光共染色,验证了复发患者中的PD-L1+CD103+ DC细胞显著增多(图3G),这表明PD-L1+CD103+ DC细胞可能在HCC复发中起着关键作用。

图3 从空间信息特征揭示PD-L1+CD103+ DC细胞与早期HCC复发的相关性
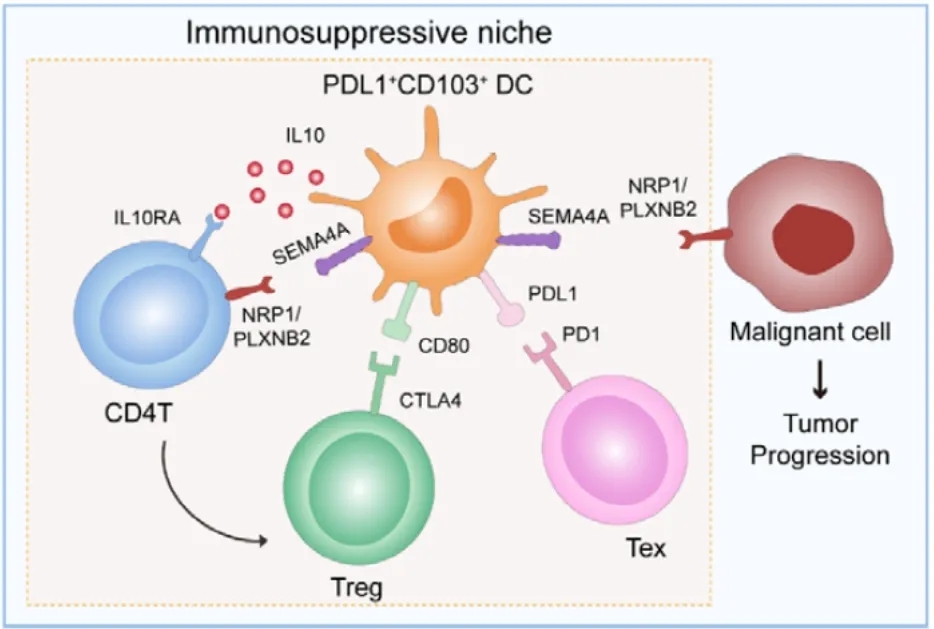
以PD-L1+CD103+ DC细胞为核心的免疫抑制/逃逸微环境
鉴于PD-L1+CD103+ DC细胞与免疫抑制细胞(Treg和Tex)之间的强相关性,作者从单细胞公共数据库发现了一群保守的PD-L1+CD103+ DC细胞基因集marker,富集分析显示这些基因在免疫应答、细胞粘附和细胞迁移相关的途径中都有显著相关性,而这些途径都与HCC的进展和转移有着复杂的联系(图4A~C),作者认为PD-L1+CD103+ DC细胞可能具有将典型CD4+ T细胞转化为Treg细胞的能力;不仅如此,PD-L1+CD103+ DC细胞还能够与Tex细胞互作,导致Tex功能损伤。这些发现都表明,PD-L1+CD103+ DC细胞C与Treg、Tex细胞密切相关,共同导致免疫抑制和免疫逃逸(图4D)。
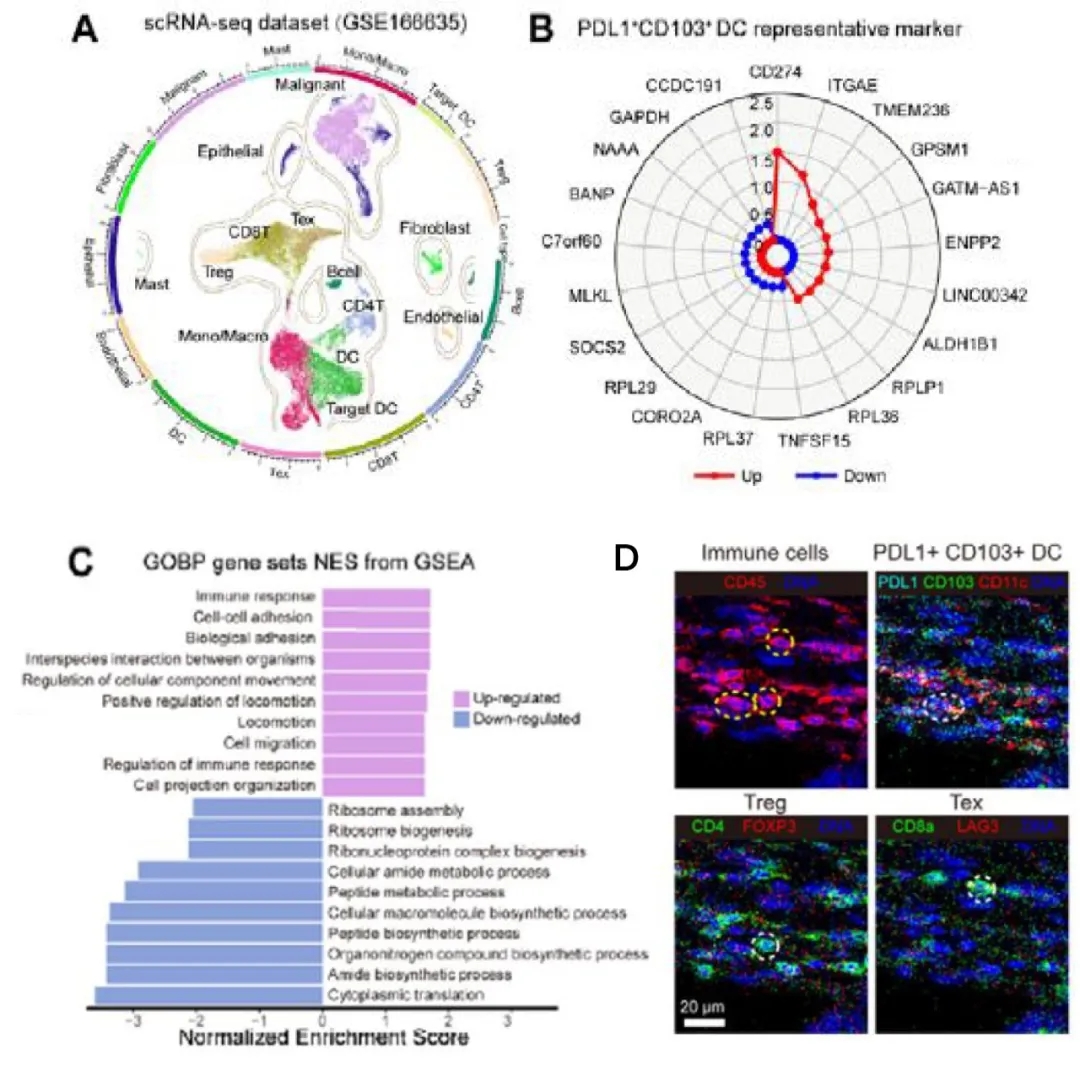
图4 以PDL1+CD103+ DC细胞为核心的免疫抑制/逃逸微环境
本文借助空间单细胞蛋白组技术准确地描绘了原发性和复发性HCC患者的肿瘤微环境,将肿瘤微环境描述为一个动态的系统。该研究对免疫细胞如何参与HCC的病理过程做出了重要的解释,描绘了肿瘤微环境中促进HCC早期复发的空间互作机制,为复发的复杂机制研究提供了宝贵的资料,为相关生物标志物和治疗干预手段开发提供了新的理论依据。